 Odgovori na
postavljena pitanja - Biologija
Odgovori na
postavljena pitanja - Biologija

 Odgovori na
postavljena pitanja - Biologija
Odgovori na
postavljena pitanja - Biologija

293. Molim vas da mi nešto detaljnije opišete sljedeće metode istraživanja stanica, te preporučite neku knjigu ili internet stranicu.
KULTURA STANICA
Animalne stanice
Mogućnost proučavanja satnica uvelike ovisi o njihovoj sposobnosti rasta, kao i podložnosti manipulacijama u laboratorijskim uvjetima. Uzgoj biljnih i animalnih stanica u kulturi puno je težio i zahtjevniji od uzgoja bakterija i kvasaca. In vitro stanični sistem omogućava jednostavnije proučavanje staničnog rasta i diferencijacije, te provođenje genetskih manipulacija potrebnih za razumijevanje strukture gena i njihove funkcije.
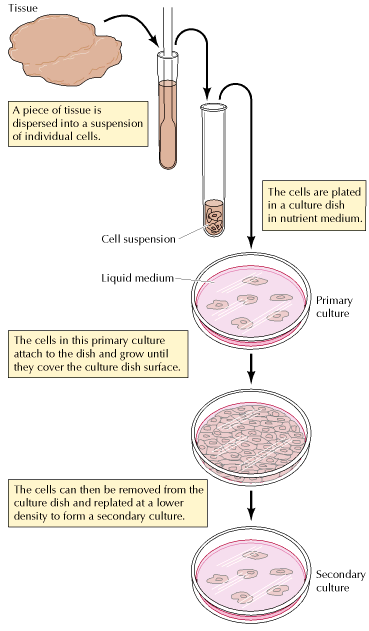 |
Kako bi dobili primarnu kulturu animalnih stanica potrebno je iz komadića tkiva dobiti suspenziju pojedinačnih stanica. Takva suspenzija se potom doda u plastične posudice koje sadrže hranjivi medij. Većina tipova animalnih stanica, poput stanica fibroblasta i epitelnih stanica, rastu pričvršćene uz podlogu. Budući da sadrže velik broj stanica koje se brzo dijele, embrionalna i tumorska tkiva često predstavljaju ishodišni materijal. Embrionalni fibroblasti posebno dobro rastu u kulturi i jedan su od najbolje proučenih tipova animalnih stanica. Ipak u odgovarajućim uvjetima moguć je uzgoj i već diferenciranih stanica.
Medij potreban za rast aminalnih stanica je vrlo složen. Prvotni medij koji se koristio u kulturi sastojao se od komponenti čiji kemijski sastav nije moguće točno definirati, poput plazme, seruma i embrionalnog ekstrakta. Veliki napredak je postignut 1955. g. kada je Harry Eagle opisao prvi definirani medij. Uz soli i glukozu, u sastav medija ulazi i svih 20 amino kiselina, te vitamini. Serum, koji je neizostavna komponenta medija, služi kao izvor polipeptidnih faktora rasta koji stimuliraju staničnu diobu, te su ključni u procesima diferencijacije i stanične komunikacije.
Početnu kulturu, uspostavljenu iz komadića tkiva, nazivamo primarnom kulturom (Slika 1.). Stanice u primarnoj kulturi obično rastu dok ne pokriju površinu posudice u kojoj se uzgajaju. Ukoliko želimo dalje održavati kulturu, stanice je potrebno odići od površine i jedan manji broj nasaditi u novu posudicu. Ovakvu kulturu sada nazivamo sekundarnom. Proces presađivanja moguće je ponavljati neograničen broj puta, ali većina normalnih stanica humanog porijekla u kulturi ne može rasti beskonačno. Na primjer, normalni ljudski fibroblasti mogu obično biti kultivirani kroz 50 do 100 diobi, nakon čega prestaju u rastom i umiru. Suprotno tome, stanice dobivene iz tumorskog tkiva mogu neograničeno dugo proliferirati u kulturi i njih nazivamo besmrtnom staničnom linijom. Ovakve postojane stanične linije su posebno korisne za mnoge tipove eksperimenata budući da predstavljaju kontinuirani i uniforman izvor materijala.
U optimalnim uvjetima, vrijeme diobe većine aktivno rastućih animalnih stanica iznosi otprilike 20h, što je deset puta duže od vremena diobe kvasca. Ovo je razlog što su eksperimenti na animalnim stanicama u kulturi puno zahtjevniji i traju puno duže od onih na bakterijama i kvascima. Ipak, genetske manipulacije animalnim stanicama u kulturi su neizostavne za naše razumijevanje stanične strukture i funkcije.
Biljne stanice
Biljne stanice je također moguće uzgajati na hranjivom mediju koji sadrži odgovarajuće regulatore rasta. Nasuprot polipeptidnim faktorima rasta koji reguliraju proliferaciju većine animalnih stanica, regulatori rasta biljnih stanica su malene molekule koje mogu proći kroz staničnu stjenku. Ukoliko je osigurana odgovarajuća kombinacija regulatora rasta moguća je proliferacija mnogih tipova biljnih stanica u kulturi, pri čemu dolazi do nastanka nakupine nediferenciranih stanica, koju nazivamo kalusom.
Karakteristika koja je specifična za biljne stanice, a ne postoji kod animalnih stanica je totipotentnost. Diferencirane animalne stanice, poput fibroblasta, nemaju sposobnost dediferencijacije i prelaska u neki drugi tip stanica, poput npr. živčanih stanica. Mnoge biljne stanice su pak sposobne formirati bilo koji drugi tip stanica ili tkiva, koji su na kraju potrebni za regeneraciju cijele biljke. Dakle, pravilnom kombinacijom hranjivih tvari i regulatora rasta nediferencirane biljne stanice u kulturi mogu biti inducirane na formiranje različitih biljnih tkiva, uključujući i korijen, stabljiku i listove. Mogućnost regeneracije cijele biljke iz samo jedne stanice, ostavlja mnoge mogućnosti za daljnja istraživanja.
CENTRIFUGIRANJE
Centrifugiranje je moćna i generalno primjenjiva metoda za razdvajanje i analizu stanica, organela i bioloških makromolekula. Čestica koja se kreće u krug polumjera r, kutnom
brzinom ω, podvrgnuta je centrifugalnom polju koje iznosi ω2r. Centrifugalna sila Fc, koja djeluje na ovu česticu jednaka je umnošku
efektivne mase čestice m' i centrifugalnog polja:
Čestica se u polju giba konstantnom brzinom v, koja je proporcionalna centrifugalnoj sili, pri čemu je f koeficijent trenja čestice:
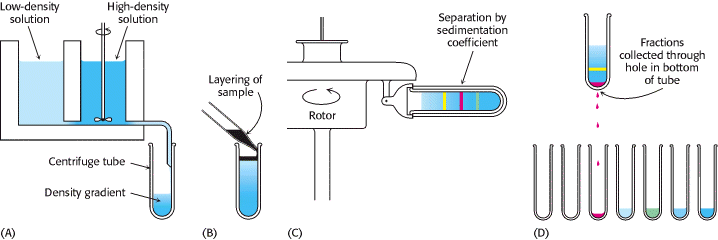 |
Želimo li odvojiti proteine obzirom na različitu brzinu sedimentacije, možemo se poslužiti centrifugiranjem (Slika 2.). Prvi korak u zonalnom centrifugiranju je formirati gradijent gustoće u tubi za centrifugiranje i to miješanjem različitih omjera otopine malene gustoće (npr. otopina 5% saharoze) i one visoke gustoće (npr. 20% otopina saharoze). Maleni volumen otopine koji sadrži mješavinu proteina se potom nanese na vrh koncentracijskog gradijenta. Kada se zavrti rotor, proteini se počinju gibati kroz gradijent i razdvajati. Centrifuga se zaustavlja prije nego najbrži protein dosegne dno tube. Razdvojene pruge proteina sakupimo na način da napravimo rupa na dnu tube i potom sakupljamo frakcije, koje je onda moguće dalje analizirati.
GEL ELEKTROFOREZA
Molekule koje posjeduju određeni naboj će se kretati u električnom polju. Ovaj fenomen, poznat kao elektroforeza, omogućava razdvajanje proteina i drugih makromolekula, poput DNA i RNA.
Brzina gibanja proteina (ili neke druge makromolekule) u električnom polju ovisi o jakosti električnog polja, naboju, masi i obliku molekule koja migrira, te o viskoznosti medija.
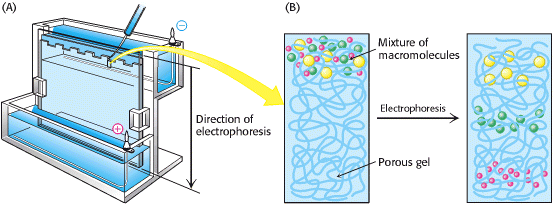
Razdvajanja elektroforezom se gotovo uvijek odvijaju u gelu (ili na čvrstim podlogama, poput papira), zato što gel služi kao molekularno sito koje poboljšava razdvajanje. Molekule koje su malene u usporedbi sa porama gela olakšano se kreću kroz gel, dok molekule koje su mnogo veće od pora su gotovo inertne. Molekule srednje veličine se kreću kroz gel različitom brzinom.
Elektroforeza proteina se odvija na tankoj, vertikalnoj ploči poliakrilamida. Tok struje je od vrha prema dnu. Poliakrilamid nastaje polimerizacijom akrilamida i umrežavanjem sa metilenbisakrilamidom. Poliakrilamid dobar je medij budući da je kemijski inertan i jednostavno nastaje (Slika 3.).
 |
Proteini se najčešće razdvajaju elektroforezom na temelju mase, u poliakrilamidnom gelu, u denaturirajućim uvjetima. Tretirajući mješavinu proteina otopinom koja sadrži natrijev dodecil sulfat (SDS) dolazi do denaturacije. SDS je anionski detergen koji ometa gotovo sve nekovalentne interakcije u nativnom proteinu. Anioni SDS se vežu na glavni lanac u omjeru otprilike jedan anion SDS na svake dvije amino kiselinske podjedinice. Ovaj kompleks SDS-a sa denaturiranim proteinom ima veliki negativni naboj, koji je u grubo proporcionalan masi proteina. Negativan naboj koji je nastao vezivanjem SDS-a je u pravilu puno veći od naboja koji nosi nativni protein, pa taj naboj nativnog proteina postaje zanemariv. Kompleks SDS - protein se zatim podvrgne elektroforezi. Kada je elektroforeza gotova, proteine u gelu je moguće vizualizirati bojanjem sa srebrom ili bojom poput Coomassie blue. Radioaktivno obilježene proteine moguće je detektirati autoradiografski.
Maleni proteini se gibaju brže kroz gel, dok veliki proteini ostaju pri vrhu, u blizini mjesta nanošenja uzorka. SDS-poliakrilamid gel elektroforeza (SDS-PAGE) je brza, osjetljiva i pouzdana metoda.
Izoelektrično fokusiranje
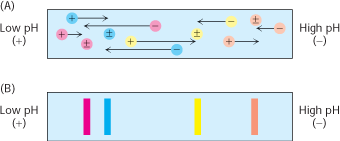
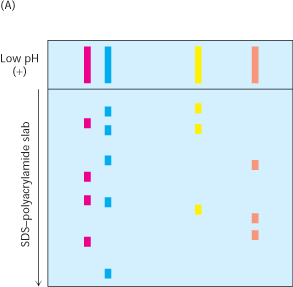
Proteine je moguće elektroforetski razdvojiti i na temelju relativnog sastava kiselih i bazičnih podjedinica. Izoelektrična točka (pI) proteina je pH pri kojemu je neto naboj proteina jednak nuli. Pri tom pH je i elektroforetska pokretljivost jednaka je nuli. Ukoliko mješavinu proteina podvrgnemo elektroforezi u nedenaturirajućim uvjetima u gelu u kojem je uspostavljen pH gradijent, svaki protein će se gibati dok ne dosegne mjesto u kojemu je pH gela jednak pI proteina (Slika 4.). Metoda razdvajanja proteina na temelju njihove izoelektrične točke se naziva izoelektrično fokusiranje. Na ovaj način moguće je razdvojiti proteine koji se razlikuju u pI za 0.01.
 |
Dvodimenzionalna gel ektroforeza
Izoelektrično fokusiranje moguće je kombinirati sa SDS-poliakrilamid gel elektroforezom kako bi se postigla visoka rezolucija razdvajanja (Slika 5.). Uzorak se prvo podvrgne isoelektričnom fokusiranju i to na gelu u jednoj liniji. Ovakav gel potom premjestimo na vrh vertikalno postavljenog SDS-polikakrilamidnog gela. Proteini su sada raspoređeni po vrhu poliakrilamidnog gela obzirom koliko su daleko doputovali tijekom isoelektričnog fokusiranja. Podvrgnemo ih zatim elektroforezi u vertikalnom smjeru i kao produkt dobivamo dvodimenzionalni uzorak. U ovakvome gelu uzorci su razdvojeni u horizontalnom smjeru na temelju njihove izoelektrične točke i u vertikalnom smjeru na temelju mase.
 |
Agarozna gel elektroforeza
Ukoliko imamo uzorak molekula DNA različite dužine i želimo ih razdvojiti koristimo se agaroznom gel elektroforezom. Molekule DNA su negativno nabijene, pa će pod utjecajem električnog polja migrirati od negativnog ka pozitivnom polu. Kraće linearne molekule DNA će putovati brže od onih dužih molekula.
KROMATOGRAFIJA
Kromatografija objedinjuje nekoliko metoda kojima je zajednički cilj razdjeljivanje makromolekula.
Gel-filtracijska kromatografija
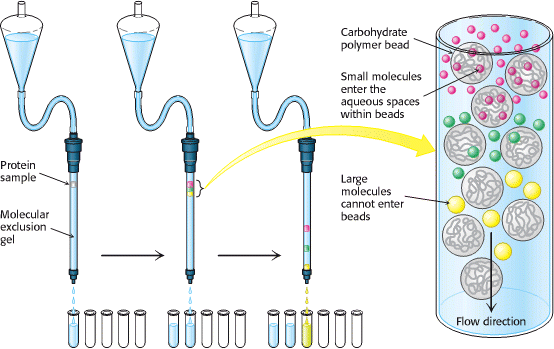
Razdvajanje molekula na temelju veličine moguće je postići gel-filtracijskom kromatografijom (Slika 6.). Uzorak se nanese na vrh kolone u kojoj se nalaze vezikule sačinjene od netopivog, ali visoko hidratiziranog polimera kao što je dekstran, agaroza ili poliakrilamid. Malene molekule mogu ući unutar tih vezikula, dok velike molekule ne mogu. Rezultat je da se malene molekule raspoređuju u vodenom mediju unutar vezikula, ali i između njih, dok su velike molekule smještene samo u mediju između vezikula. Velike molekule prolaze kolonom puno brže i stižu prve, budući da im je dostupan manji volumen medija. Molekule veličine iste kao i vezikule izlaze iz kolone srednje, dok najmanje molekule izlaze posljednje.
 |
Ion-izmjenjivačka kromatografija
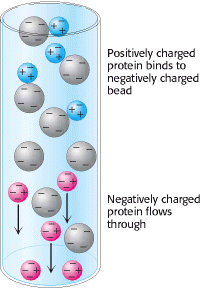
Molekule je moguće razdvojiti i na temelju njihovog ukupnog naboja metodom ion-izmjenjivačke kromatografije. Ukoliko je neto naboj npr. proteina pri pH 7, taj protein će se obično vezati na kolonu sa vezikulama koje sadrže karboksilne skupine, dok se negativno nabijeni proteini neće vezati. (Slika 7.). Pozitivno nabijeni protein, vezan na kolonu moguće je ukloniti, tj. isprati sa kolone ukoliko u puferu za ispiranje povećamo koncentraciju natrijevog klorida ili neke druge soli. Ovime povećavamo koncentraciju iona natrija koji se natječu sa pozitivno nabijenim skupinama proteina za vezujuća mjesta na koloni. Proteini koji imaju malu gustoću neto pozitivnog naboja će biti isprani prvi, nakon čega slijede oni sa većom gustoćom naboja.
 |
Afinitetna kromatografija
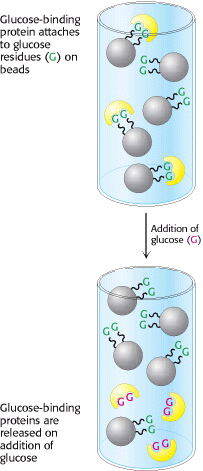
Afinitetna kromatografija je učinkovita i generalno primjenjiva metoda za pročišćavanje skupina molekula od interesa. Ova tehnika se zasniva na visokom afinitetu pojedinih makromolekula za specifične kemijske skupine (Slika 8.). Jedna od primjena afinitetne kromatografije je u izolaciji transkripcijskih faktora, proteina koji reguliraju ekspresiju vezujući se za specifičnu sekvencu na DNA. Mješavina proteina se propušta kroz kolonu koja sadrži specifičnu DNA sekvencu vezanu na matriks; proteini sa visokim afinitetom vezivanja na sekvencu će zaostati na koloni. Transkripcijski faktor će biti otpušten ukoliko se kolona ispere sa otopinom koja sadrži visoku koncentraciju soli. Općenito, afinitetnom kromatografijom je moguće izdvojiti protein koji prepoznaje grupu X, ukoliko se na kolonu kovalentno vezuje X ili njegov derivat. Dodavanjem mješavine proteina na tu kolonu, te zatim ispiranjem, uklanjaju se proteini koji se nisu vezali, dok daljnjim ispiranjem uz dodavanje visoke koncentracije topivog X ili narušavanjem uvjeta vezivanja dobivamo protein od interesa. Afinitetna kromatografija je najučinkovitija kada je interakcija između proteina i molekule koju on prepoznaje visoko specifična.
 |
Visoko tlačna tekućinska kromatografija (HPLC)
Visoko tlačna tekućinska kromatografija objedinjuje i poboljšava gore navedene kromatografske metode. Materijali koji ispunjavaju kolonu su puno finije odijeljeni, što ima za posljedicu veći broj mjesta dostupnih za interakciju, a time je i povećana moć razlučivanja. Budući da je kolona sastavljena od finijih materijala, potrebno je upotrijebiti tlak, kako bi se uspostavio kontinuirani protok. Krajnji rezultat je visoka razlučivost, kao i brzo odjeljivanje.
MIKROINICIRANJE
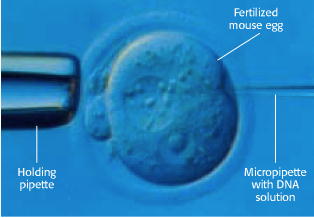
Molekule rekombinantene DNA moguće je unijeti u animalne stanice na nekoliko načina. Jedna od metoda je unos strane DNA prethodno precipitirane kalcijevim fosfatom u animalnu stanicu. Malena količina unesene DNA biva stabilno ugrađena u kromosomalnu DNA. Iako je efikasnost ugradnje malena, metoda se često primjenjuje zbog svoje jednostavnosti. U drugoj metodi molekule DNA se u stanicu unose mikroiniciranjem. Staklenu mikropipetu sa vrlo tankim vrškom (promjera svega 0.1 mm), u kojem se nalazi suspenzija strane DNA, iniciramo u jezgru stanice primaoca (Slika 9.). Vještom znanstveniku moguće je napraviti i do tisuću iniciranja u jednome satu. Oko 2% mišjih stanica u koje smo inicirali stranu DNA ostanu vijabilne i sadrže novi gen. Kao učinkovit vektor za unos strane DNA u animalne stanice mogu nam poslužiti i retrovirusi (za nešto više o ovome pogledaj u navedenoj literaturi).
 |
NUKLEARNA MAGNETSKA REZONANCIJA (NMR)
NMR spektroskopija je jedinstvena metoda za otkrivanje atomske strukture makromolekula u otopini. Ona se temelji na činjenici da su određene atomske jezgre pravi magneti. Samo ograničeni broj izotopa pokazuje tu karakteristiku, koju još nazivamo spin. Najjednostavniji primjer je jezgra vodika (1H), koja je proton. Vrtnja protona generira magnetski moment. U trenutku kada se primjeni vanjsko magnetsko polje taj moment može poprimiti jednu od dvije orijentacije ili spin stanja koja nazivamo α i β (Slika 10.). Energetska razlika između dva spin stanja proporcionalna je snazi primijenjenog vanjskog magnetskog polja.
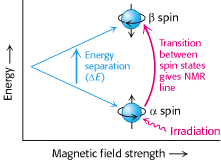 |
Stanje α je stanje nešto niže energije i stoga je malo više naseljeno. Proton koji se nalazi u stanju α može biti pobuđen i prijeći u β stanje primjenom pulsa elektromagnetskog zračenja. Frekvencija primijenjenog zračenja je proporcionalna energetskoj razlici između α i β stanja. U ovim okolnostima spin protona će se promijeniti iz α stanja u β stanje, drugim riječima doći će do pojave rezonancije. NMR spektar određene molekule moguće je dobiti variranjem magnetskog polja, pri konstantnoj frekvenciji elektromagnetskog zračenja ili održavanjem magnetskog polja konstantnim, te variranjem frekvencije elektromagnetskog zračenja.
Ove karakteristike je moguće upotrijebiti za ispitivanje kemijske okoline vodikovih jezgara. Protok elektrona oko magnetske jezgre uzrokuje generiranje malenog lokalnog megnetskog polja koje se suprotstavlja primijenjenome polju. Stupanj jakosti takvog lokalnog polja ovisi o elektronskoj gustoći u neposrednoj blizini jezgre. Dakle, jezgre u različitim okruženjima će mijenjati stanja ili rezonirati pri različitim jakostima polja ili različitim frekvencijama zračenja.
Tehnikom jednodimenzionalnog NMR-a moguće je odrediti položaj većine protona u proteinima. Na ovaj način možemo odrediti promjene u specifičnim kemijskim skupinama pod različitim uvjetima, kao što su konformacijski prijelazi iz nedefinirane strukture u npr. α heliks.
RENGENSKA STRUKTURNA ANALIZA
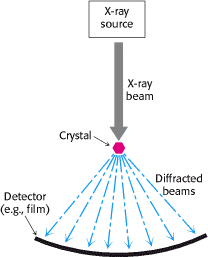
Rengenska strukturna analiza ili kristalografija X-zrakama predstavlja trenutno najfiniju metodu vizualizacije proteinske strukture. Ovom tehnikom je moguće odrediti točan trodimenzionalni raspored većine atoma u određenoj makromolekuli (npr. proteinu). Upotreba X-zraka daje najbolju razlučivost, budući da je valna duljina X-zraka otprilike ista kao i duljina kovalentne veze. Tri su bitne komponente u kristalografskoj analizi X-zrakama: kristali makromolekula (npr. proteina), izvor X-zraka i detektor (Slika 11.).
 |
Jedana od nužnosti ove tehnike je pravilna orijentacija molekula. Stoga je prvi korak dobiti protein od interesa u kristalnom obliku. To je moguće postići dodavanjem amonijevog sulfata ili neke druge soli u koncentriranu otopinu proteina. Na taj način reducira se topivost i favorizira formiranje kristala. Ovaj proces nazivamo još i isoljavanjem. Iz proteinskih kristala često je moguće uvidjeti i biološku aktivnost proteina, što ukazuje da su pojedini proteini kristalizirali u njihovoj biološki aktivnoj konfiguraciji.
Dalje nam je potreban izvor X-zraka. Snop X-zraka valne duljine 1.54 Á dobivamo ubrzavanjem elektrona o bakrenu metu. Uski snop X-zraka pogađa proteinski kristal. Dio zraka prolazi ravno kroz kristal, dok se ostatak zraka ogiba u različitim smjerovima. Na posljetku ove raspršene tj. difrakcijske X-zrake detektiramo na filmu. Zacrnjenje emulzije proporcionalno je intenzitetu raspršenja snopa X-zraka. Uzorak koji dobijemo odražava strukturu proteina (za nešto više o ovome pogledaj u navedenoj literaturi).
Do sredine 2000. godine NMR-om i kristalografijom X-zrakama razriješena je struktura više od 10,000 proteina. Njihove koordinate moguće je naći u Protein Dana Bank (http://www.rcsb.org/pdb), a strukture je moguće vizualizirati i analizirati. Poznavanjem molekularne strukture proteina moguće je uvidjeti i na koji način proteini prepoznaju i vežu se na druge molekule, kako funkcioniraju kao enzimi, kako se smataju, te na koji način su evoluirali.
AUTORADIOGRAFIJA
Jedna od najvažnijih primjena radioaktivnosti u staničnoj biologiji je lokalizacija radioaktivnih komponenti u odjeljcima čitavih stanica ili tkiva autoradiografijom. Žive stanice se kratko izlože pulsu specifične radioaktivne komponente i inkubiraju određeni period kako bi došlo do ugradnje. Svaki preparat se zatim prevuče tankim filmom koji sadrži fotografsku emulziju i ostavi u marku nekoliko dana, tijekom čega se radioaktivni izotop raspada. Film se potom razvije. Na mjestima gdje je bilo došlo do ugradnje radioaktivnih čestica u stanici, na filmu se pojavljuju srebrne mrlje.
Ukoliko stanice izložimo 3H-timidinu, radioaktivnom prekursoru DNA, moguće je npr. pokazati da DNA nastaje u jezgri i ostaje tamo. Suprotno, ako stanice uzgajamo na podlozi sa 3H-uridinu, radioaktivnim prekursorom RNA, moguće je otkriti da RNA primarno nastaje u jezgri, a zatim se brzo prenosi u citoplazmu.
Radioaktivno označene molekule moguće je također detektirati autoradiografski nakon razdvajanja od ostalih molekula na gelu, elektroforezom. Položaj proteina , ali i nukleinskih kiselina na gelu često se određuje na ovaj način.
Barbara Bohaček
apsolvent, smjer: molekularna biologija
Prirodoslovno-matematički fakultet, Zagreb